Atomkerns
- Die Entdeckung des Atomkern
Auch ERNEST RTHERFORD (1871-1937) beschäftigt sich mit der Frage der Struktur der Atome. In seinem Labon fürhteen HANS GEIGER und ERNEST MARSDEN ihre Experimente anders als LENARD nicht mit Elektronen, sondern mit a-Teilchen durch. RUTHERFORD hatte entdeckt, dass eine Alphastrahlung aus einzelnen a-Teilchen besteht, und zwar aus zweifach geladenen Heliumionen, die etwa die 7000-fache Masse eines Elektrons besitzen. Nach dem Thomson'schen Atommodell nahm RUTHERFORD an, dass die positive Ladung der Helium-lonen über ein relativ großes Volumen homogen verteilt ist. RUTHERFORD verwenden einen Aufbau.Schau "Prinzip des Rutherford-Experiment". In einem solchen Experiment durchdringt ein großer Anteil a-Teilchen die Goldfolie, ohne abgelenkt zu werden. Schau "QEDK5978" .Einige Teilchen werden jedoch stark von ihrer ursprünglichen Bahn abgelenkt. Das gleiche Ergebnis zeigt sich auch, wenn Folien aus anderen Materialien eingesetzt werden.
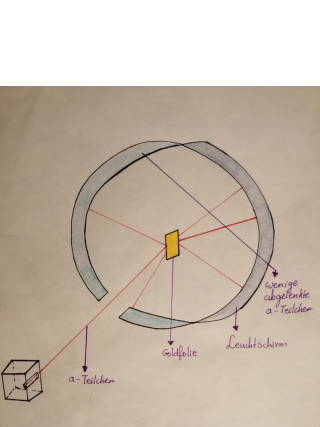
Eine intsensive radiodaktive Qeellen setzt a-Teilchen einen großen kinetischen Energie frei, die als feiner Strahl auf eine wenige Mikrometer dünne Goldfolie treffen. Eine Szintillationsschirm erzeugt bei Aufprall der a-Teilchen kleine Lichtblitze, die dann mithilfe eines Mikroskop registriert und gezählt werden. Die Größe Anteile a-Teilchen passiert die Goldfolie ungehindert, aber ein geringerer Anteil wird von seiner Bahn abgelenkt, einiger Teilchen sogar unter einen Winkel von nahezu 180 %.
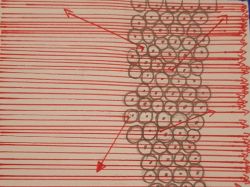
Interpretation der Streuexperimente: Das Ergebnis Experiments war für RUTHERFORD zunächst unverständlich. Denn nach dem Thomson'schen Atommodel mit einer gleichförmigen Verteilung der Materie allenfalls Abschwächung der Strahlintensität, nicht aber einer dermaßenen starken Ablenkung einiger Teilchen erwertet worden. RUTHERFORD hat noch malgesehen.
Die positiven geladenen Teilchen werden von den Elektronen in der Folie so gut gar nicht beeinflusst, aber von den massereichen pdenen Teile mussten nach den Berechnungen von RUTHERFORD sehr klein sein; dies lässt sich aus der Intensität der rückwärts gestreuten a-Teilchen schlieben. Der Grund war dieser Überlegungen gelangte Rotherford zu neuen Schlussfolgerungen über den Bau der Atome.
Der innere Struktur ist sehr kleiner, positiv geladener Atomkern enthält fast die gesamten Masse des Atoms.Sein Radius liegt in der Größenordnung von 10-14 m und ist etwa 100000-mal kleiner als der Atomradius. Um ihn herum existiert eine »Wolke«.negative geladener Elektronen.
Ein Atom besteht aus Protonen(positive geladene Teilchen) und Neutronen (ungeladene Teilchen) Die Protonen und die Neutronen Biden sich zusammen die Nukleonen. Da die Elektronen, die sich in der Atomhülle befinden im Gegensatz zu den Protonen und Neutronen eine viel kleiner Masse besitzen, sitz die Masse des Atoms nahezu vollständig sich im Atomkern.
(Elektronenmasse: m Elektronen = 9,109*10-31kg Protonenmasse: m Protonen = 1,6749* 10 hoch Minus 27 Neutronenmasse: m Neutronenmasse = 1,6749*10hoch Minus 27).
Oft wird die atommasse in der atomaren Masseneinheit (Da) angegeben: 1 Da= 1,6605402*10 hoch Minus 27kg. Neutronen und Protonen haben ungefähr die Masse 1 Da.