Einfache Kohlenwasserstoffe
Einfache Kohlenwasserstoffe
Einfache Kohlenwasserstoffe sind organische Verbindungen, welche aus den Elementen Kohlenstoff C und Wasserstoff H bestehen. Zu diesen zählen die Alkane, Alkene und Alkine, wobei Alkane als gesättigte Kohlenwasserstoffe gelten und die Alkene und Alkine zu den ungesättigten Kohlenwasserstoffen zählen. Die einfachen Kohlenwasserstoffe werden zu den Aliphatischen Kohlenwasserstoffen gezählt, da es sich hierbei um kettenförmige, verzweigte oder unverzweigte Kohlenwasserstoffe handelt.
Einteilung ausgewählter Kohlenwasserstoff-Gruppen
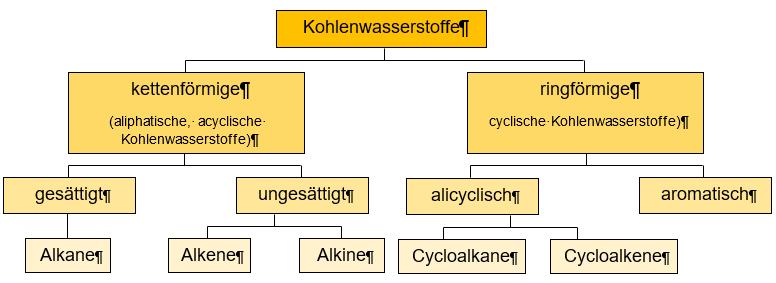
Kohlenwasserstoffe können in zwei Hauptgruppen eingeteilt werden: Die kettenförmigen (Aliphatische Kohlenwasserstoffe und Acyclische Kohlenwasserstoffe) und die ringförmigen (cyclische Kohlenwasserstoffe) Kohlenwasserstoffe. Kettenförmige Kohlenwasserstoffe können nun weiter unterteilt werden in die gesättigten (Alkane) und ungesättigten (Alkene und Alkine) Kohlenwasserstoffe und die ringförmigen Kohlenwasserstoffe in die alicyclischen (Cycloalkane und Cycloalkene) und aromatischen Kohlenwasserstoffe.
In diesem Beitrag sollen die einfachen, also Kettenförmigen Kohlenwasserstoffe, betrachtet werden.
kettenförmige Kohlenwasserstoffe
Alkane
Die Alkane zählen in der Organischen Chemie zu den einfachsten Kohlenwasserstoffe. Sie sind kettenförmig und in den Molekülen nur über Einfachbindungen verbunden, weshalb sie als gesättigte Kohlenwasserstoffe zählen. Als einfachstes Alkan zählt das Methan (CH4). Dieses besteht aus einem Kohlenstoffatom, welches je ein Elektronenpaar mit vier Wasserstoffatomen ausbildet. Diese vier bindenden Elektronenpaare stoßen sich gegenseitig ab und nehmen den größtmöglichen Abstand zueinander ein, weshalb die vier Wasserstoffatome ein Tetraeder bilden, in dessen Zentrum sich das Kohlenstoffatom befindet. Methan zählt als Hauptbestandteil des Erdgases und zählt als ein starkes Treibhausgas, welches einen viermal höheren Treibhauseffekt aufweist als Kohlenstoffdioxid.
| Name | verkürzte Strukturformel | Summenformel |
|---|---|---|
| Methan | CH4 | CH4 |
| Ethan | CH3-CH3 | C2H6 |
| Propan | CH3-CH2-CH3 | C3H8 |
| Butan | CH3-(CH2)2-CH3 | C4H10 |
| Pentan | CH3-(CH2)3-CH3 | C5H12 |
| Hexan | CH3-(CH2)4-CH3 | C6H14 |
| Heptan | CH3-(CH2)5-CH3 | C7H16 |
| Octan | CH3-(CH2)6-CH3 | C8H18 |
| Nonan | CH3-(CH2)7-CH3 | C9H20 |
| Decan | CH3-(CH2)8-CH3 | C10H22 |
Es sind zahlreiche Kohlenwasserstoffe mit einer Methan ähnlichen Struktur bekannt, welche in der homologen Reihe der Alkane zusammengefasst werden. Hierbei beschreibt der Wortstamm die Anzahl der Kohlenstoffatome in einem Alkanmolekül. Die Namen der Alkane werden aus diesen Wortstämmen und der Endung -an gebildet. Als homologe Reihe wird eine Gruppe von chemisch nahe verwandten Verbindungen, für die man eine gemeinsame Summenformel angeben kann, bezeichnet.
Die Alkane unterscheiden sich immer um eine Kohlenstoffatom und zwei Wasserstoffatome, also um eine -CH2-Gruppe. Daraus lässt sich die allgemeine Summenformel für die Alkane ableiten: CnH2n+2
Aufgrund der immer gleichen Sturktur der Alkane zeigen sie ähnliche chemische und physikalische Eigenschaften. Ein Beispiel hierfür ist die Verbrennung: Alkane verbrennen bei ausreichender Sauerstoffzufuhr immer vollständig unter Wärmeabgabe zu Kohlenstoffdioxid und Wasser.
Beispiel: Verbrennung von Propan:
- C3H8 + 5 O2 → 3 CO2 + 4 H2O
- C3H8 + 5 O2 → 3 CO2 + 4 H2O
Bei Sauerstoffmangel verbrennen Alkane unvollständig und es entstehen das giftige Kohlenstoffmonooxid (CO), Wasser und / oder reiner Kohlenstoff (Ruß).
Mit Halogenen bilden die Alkane so genannte Halogenkohlenwasserstoffe, aber ansonsten sind Alkane wenig reaktiv.
Die physikalischen Eigenschaften der Alkane ähneln sich ebenfalls. So sind die unpolaren Moleküle schlechte elektrische und Wärmeleiter. In Schmelzen von Alkanen liegen ebenso wenig Ionen vor, weshalb flüssige Alkane - anders als Salzschmelzen - den elektrischen Strom nicht leiten. Durch die Unpolarität lassen sich die Alkane nicht in Wasser lösen.
Durch einen Masseunterschied, welcher durch die -CH2-Differenz hervorgerufen wird, gibt es jedoch graduelle Unterschiede, weshalb nur die ersten vier Alkane bei Normbedingungen gasförmig sind. Das erste flüssige Alkan ist Pentan und mit zunehmender Kettenlänge wird die Beschaffenheit ölig. Ab einer Anzahl von 17 Kohlenstoffatomen (ab Heptadecan) liegen die Alkane im festen Zustand vor.
Alkene
Alkene zählen zu den ungesättigten Kohlenwasserstoffen. Diese enthalten in ihren Molekülen mindestens eine C-C-Mehrfachbindung. Die Alkene besitzen eine oder mehrere Doppelbindungen und bilden eine homologe Reihe mit der Summenformel C2H2n. Die Namen der Alkene bilden sich wieder aus dem Wortstamm, welcher aus der Anzahl der Kohlenstoffatome resultiert und diesmal aus der Endung -en .
Da die Alkene ebenfalls unpolare Kohlenwasserstoffe sind, lassen sie sich, genau wie die Alkane, auch nicht in Wasser lösen. Sie Verbrennen, bei ausreichender Sauerstoffzufuhr, genau wie die Alkane, vollständig zu Kohlenstoffdioxid und Wasser. Die physikalischen Eigenschaften sind denen der Alkane sehr ähnlich.
Ein großer Unterschied zwischen den Alkanen und Alkenen besteht in den chemischen Reaktionen. Durch die Addition oder Polymerisation können leicht viele chemische Produkte gebildet werden, sodass die Alkene als wichtige Ausgangsstoffe für viele großtechnische Synthesen gelten, zum Beispiel in der Petrochemie u.a. zur Herstellung von Kunststoffen und Kunstfasern.
Alkine
Alkine sind kettenförmige Kohlenwasserstoffe, welche in ihren Molekülen mindestens eine Dreifachbindung enthalten und zählen wie die Alkene zu den ungesättigten Kohlenwasserstoffen. Sie bilden eine homologe Reihe mit der Summenformel CnH2n-2. Der Name der Alkine setzt sich wieder aus dem Wortstamm, welcher aus der Anzahl der Kohlenstoffatome resultiert und der Endung -in zusammen.
Der einfachste Vertreter der Alkine ist das Ethin. Durch die Dreifachbindung zwischen den beiden Kohlenstoffatomen in diesem Molekül ist die C-H-Bindung polarer als bei anderen Kohlenwasserstoffen, weshalb Ethin Protonen abgeben kann und in Wasser schwach sauer reagiert. Bei der Verbrennung von Ethin werden bis zu 3000°C erreicht, weshalb dieses Alkin zum schweißen verwendet wird.
Auch die Alkine verbrennen bei ausreichender Sauerstoffzufuhr vollständig zu Kohlenstoffdioxid und Wasser. Sie werden vielfach, vor allem Ethin, zur Herstellung von Ausgangsstoffen für die Kunststoffindustrie genutzt.
Übungsaufgaben
Aufgabe 1
Erstelle je eine homologe Reihe mit Namen, verkürzter Strukturformel und Summenformel für die Alkene und Alkine bis zur Kohlenstoffanzahl 10. Orientiere dich dabei an der Tabelle zur homologen Reihe der Alkane.
Aufgabe 2
Recherchiere zu weiteren Eigenschaften und Verwendungen der Alkane, Alkene und Alkine.
Aufgabe 3
Zeichne zu mindestens je drei Alkanen, Alkenen und Alkinen die ausführliche Strukturformel.