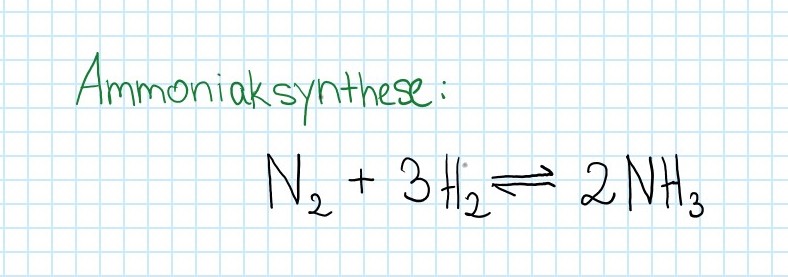Chemie: Unterschied zwischen den Versionen
| (9 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 19: | Zeile 19: | ||
== Prinzip von LeChatelier == | |||
'''Eine "Neueinstellung" des Gleichgewichts kann mit Hilfe des <u>Prinzip von LeChatelier</u> | |||
erfolgen ([[Prinzip vom kleinsten Zwang]]).''' '''[https://www.chemie-schule.de/KnowHow/Prinzip_vom_kleinsten_Zwang] | |||
Denn ''<q>Wird auf ein im Gleichgewicht befindlichen System durch Änderung der äußeren Bedingungen ein Zwang ausgeübt, so verschiebt sich das Gleichgewicht derart, dass es dem Zwang ausweicht. Es stellt sich ein neues Gleichgewicht mit vermindertem Zwang ein.</q>'' | |||
Folglich kann das chemische Gleichgewicht durch folgende Faktoren beeinflusst werden: | Folglich kann das chemische Gleichgewicht durch folgende Faktoren beeinflusst werden: | ||
1. '''Temperatur''' | 1. '''Temperatur''' [[Datei:Temperatur.jpg|mini|Temperaturveränderung]] | ||
:- Erhöht man die Temperatur, verläuft die endotherme Reaktion bevorzugt ab, bei einer Temperaturerniedrigung verläuft die exotherme Reaktion bevorzugt ab. | :- Erhöht man die Temperatur, verläuft die endotherme Reaktion bevorzugt ab, bei einer Temperaturerniedrigung verläuft die exotherme Reaktion bevorzugt ab. | ||
2. '''Konzentration''' | 2. '''Konzentration'''[[Datei: Konzentration.jpg|mini|Konzentrationsveränderung]] | ||
:- Bei einer Konzentrationserhöhung der Edukte kommt es zur Verschiebung des Gleichgewichts in Richtung der Produkte. Erhöht man die Konzentration der Edukte, verschiebt sich das Gleichgewicht zugunsten der Edukte. | :- Bei einer Konzentrationserhöhung der Edukte kommt es zur Verschiebung des Gleichgewichts in Richtung der Produkte. Erhöht man die Konzentration der Edukte, verschiebt sich das Gleichgewicht zugunsten der Edukte. | ||
3. '''Druck''' | 3. '''Druck'''[[Datei: Druck.jpg|mini|Druckveränderungen]] | ||
:- Eine Druckerhöhung bewirkt eine Verschiebung des Gleichgewichts in Richtung des Stoffes, der weniger Raum einnimmt. | :- Eine Druckerhöhung bewirkt eine Verschiebung des Gleichgewichts in Richtung des Stoffes, der weniger Raum einnimmt. | ||
Aktuelle Version vom 4. August 2020, 13:31 Uhr
Stoffe im Gleichgewicht
Das Chemisches Gleichgewicht [[1]] beschreibt einen Zustand, bei dem durch Hin- & Rückreaktion einer chemischen Reaktion die Konzentration von Edukten und Produkten nicht mehr verändert wird.
Eigenschaften des chemischen Gleichgewichts
Dabei gibt es bestimmte Eigenschaften des chemischen Gleichgewichts:
- Konstante Konzentration
- - Die Konzentration von Edukte und Produkte in einem chemischen Gleichgewicht sind konstant.
- Gleiche Geschwindigkeit der Hin- & Rückreaktion
- - Die Geschwindigkeiten der Hin- & Rückreaktionen im chemischen Gleichgewicht sind immer gleich.
- Konstante Farbe
- - Die Farbe des Stoffgemisches ist konstant, da sich die Konzentrationen der beteiligten Stoffe im chemischen Gleichgewicht nicht ändern.
Prinzip von LeChatelier
Eine "Neueinstellung" des Gleichgewichts kann mit Hilfe des Prinzip von LeChatelier
erfolgen (Prinzip vom kleinsten Zwang). [2]
Denn Wird auf ein im Gleichgewicht befindlichen System durch Änderung der äußeren Bedingungen ein Zwang ausgeübt, so verschiebt sich das Gleichgewicht derart, dass es dem Zwang ausweicht. Es stellt sich ein neues Gleichgewicht mit vermindertem Zwang ein.
Folglich kann das chemische Gleichgewicht durch folgende Faktoren beeinflusst werden:
1. Temperatur
- - Erhöht man die Temperatur, verläuft die endotherme Reaktion bevorzugt ab, bei einer Temperaturerniedrigung verläuft die exotherme Reaktion bevorzugt ab.
2. Konzentration

- - Bei einer Konzentrationserhöhung der Edukte kommt es zur Verschiebung des Gleichgewichts in Richtung der Produkte. Erhöht man die Konzentration der Edukte, verschiebt sich das Gleichgewicht zugunsten der Edukte.
3. Druck
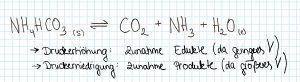
- - Eine Druckerhöhung bewirkt eine Verschiebung des Gleichgewichts in Richtung des Stoffes, der weniger Raum einnimmt.
Übungsaufgabe
Durch welche Faktoren kann die Herstellung von Ammoniak begünstigt werden?
Die Reaktion ist exotherm.
Wie muss die Temperatur, der Druck und die Konzentration geändert werden, um eine hohe Ausbeute von Ammoniak zu erreichen?
Vergleich, siehe Ammoniakdarstellung
"[ [Kategorie:A-Z] ]"