Benzol
Benzol (Synonym: Benzen; Summenformel: C6H6) auch als "Mutter der Aromaten" bezeichnet, stellt das Grundmolekül der Aromatenchemie dar. Kennzeichnend für die Chemie der Aromaten ist ihre Stabilität, welche auf den ersten Blick im Widerspruch zu ihrer Struktur zu sein scheint. Jedoch nur auf den ersten Blick, denn eben wegen ihrer besonderen Struktur und Stabilität sind die Reaktionen die solche Verbindungen eingehen keine klassischen Addition.
Geschichte des Benzols und das Mysterium um seine Struktur
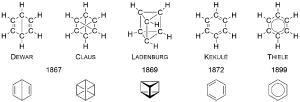
Die erste Darstellung des Benzols erfolgte durch Michael Faraday, der es als Rückstand in Leuchtgasflaschen ermittelte. Er bestimmte Schmelz- und Siedepunkt des Stoffes und in einer quantitativen Strukturanalyse postulierte er die Verhältnisformel C2H1. Was daran liegte, dass er ein Massenverhältnis von 12:1 feststellte und von einem Äquivalentgewicht von 6 für Kohlenstoff ausging.
Rund 10 Jahre später wurde durch Mitscherlich dieser "Irrtum" aufgedeckt und die Verhältnisformel C1H1, sowie die Summenformel C6H6 aufgestellt. Der Name Benzol geht auf Justus von Liebig zurück.
Eine passende Strukturformel für die Summenformel zu finden, erwies sich jedoch als schwieriger. Es gab über die Jahre verteilt mehrere Ansätze die zwar gleiche Summenformeln aufwiesen, sich jedoch in der Konnektivität der Atome untereinander unterschieden (sog. Konstitutions- bzw. Strukturisomere).
Kekulé so heißt es soll um das Jahr 1865 herum einen Traum gehabt haben, von einer Schlange, die sich selbst in den Schwanz beißt und so auf die cyclische Struktur des Kohlenwasserstoffs gekommen sein. - Je nach Quelle sind es auch mal sechs Affen, die sich im Kreis am Schwanz des Vordermanns festhalten.
1872 dann evaluierte Kekulé seine Formel und stellte zwei als gleichwertig definierte Formeln auf, die einen Wechsel der Doppelbindungen aufwießen, wir schauen uns dies im Bereich der Mesomerie später genauer an.
Heutzutage werden standardmäßig die Strukturformeln von Kekulé und Thiele verwandt, je nach zu verwendender Thematik haben beide Darstellungsvarianten ihren Vorteil. Thiele beschreibt damit das Konzept der Delokalisierung der Elektronen über das ganze Molekül verteilt. Kekulé dagegen wird klassischer Weise zur Darstellung des Konzepts der Mesomerie darzustellen, sowie in der Mechanistischen Betrachtung von Reaktionen, bei denen die Wanderung von Elektronen optisch dargestellt werden muss.
Struktur des Benzols genauer betrachtet
Besonderheiten
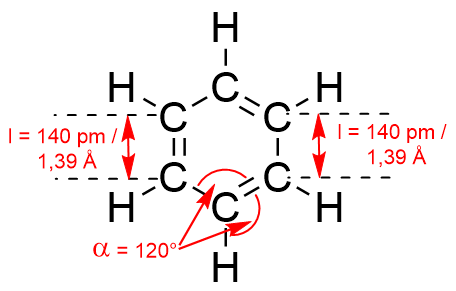
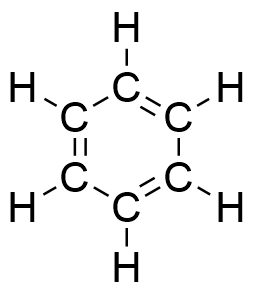
Wie oben bereits gezeigt sorgte die Struktur des Benzols bei vielen Chemikern der damaligen Zeit lange für Kopfzerbrechen. Grund dafür ist unter anderem das von der klassischen Bindungslehre abweichende Erscheinungsbild. Mittels instrumenteller Analytik können Bindungslängen und Bindungswinkel des Benzols ermittelt werden.
| C-C Einfachbindung | C=C Doppelbindung | Benzol |
|---|---|---|
| 154 pm | 134 pm | 140 pm |
Weshalb steht dies nun im Widerspruch?
Es scheint sich gleichzeitig um Doppelbindungen und gleichzeitig um Einfachbindungen zu handeln. Die normale C-C Einfachbindung beträgt l = 154 pm, die einer C=C Doppelbindung dagegen l = 134 pm. Somit ist die Bindungslänge im Benzol weder Einfach- noch Doppelbindung, sondern liegt dazwischen.
Da alle Bindungslängen gleichlang sind und die Bindungswinkel jeweils 120° betragen, ist das Molekül planar. Es befinden sich also alle an den Bindungen beteiligten Atome in einer Ebene.
Mesomerie
Mesomerie ist ein vor allem in der Organische Chemie wichtiges Konzept um der Realität einen Schritt näher zu kommen.
Dabei sind in den Abschnitten vorher bereits Probleme angesprochen wurden, die grafische Darstellung der Struktur und die Realität der Struktur miteinander zu verbinden.
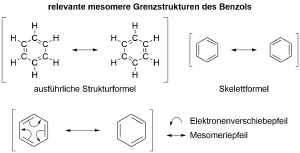
Die Mesomerie nunmehr versucht einen Kompromiss zu erreichen. Kekulé hat es 1872 bereits postuliert, dass es zwei Strukturformeln gibt, bei denen die Doppelbindungen zwischen den Kohlenstoff-Atomen hin und her springen.
Die Mesomerie ist eine grafische Methode zur Darstellung der Delokalisation von Elektronen. Dabei handelt es sich immer um Elektronen in Doppelbindungen. Die beiden Strukturformeln des Kekulé beschreiben dabei die sogenannten mesomeren Grenzstrukturen und beschreiben beide lediglich nur einen Aspekt der Realität - sind jedoch niemals allein gültig.
Da es sich bei der Mesomerie um eine Verschiebung von Elektronen handelt innerhalb eines Moleküls wird ein besonderer Pfeil, der Mesomeriepfeil verwendet um den Wechsel von einem zum anderen Molekül darzustellen, oft werden die Gesamtheit der Formeln in einer eckigen Klammer zusammengefasst. Um die Verschiebung der Elektronen noch deutlicher zumachen, können sog. Elektronenverschiebepfeile verwendet werden, sind jedoch vor allem bei Reaktionsmechanismen von Relevanz.
Vielfalt der Aromaten
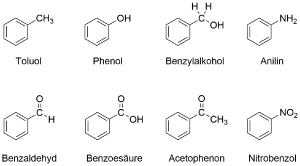
Benzol ist eines der wichtigsten Moleküle innerhalb der Gruppe der Aromaten, da es durch einfache chemische Reaktionen Ausgangsstoff für eine Vielzahl weiterer in der Industrie nützliche substituierte Benzol-Derivate ist.
Dabei bedeuten substituierte Benzol-Derivate dass an eine Benzol-Grundeinheit eine weiterer Alkyl- oder Aryl-Rest oder eine funktionelle Gruppe angefügt sind (Beziehungsweise mehrere). Diese sind meist weiterhin wichtige Industriechemikalien, wie beispielsweise Phenol und Nitrobenzol oder wichtige chemische Lösungsmittel, wie Toluol.
Auch sind beispielsweise Pikrinsäure und 2,4,6-Trinitrotoluol (TNT) als Explosivstoffe Moleküle die auf einem zentralen Benzol-Grundgerüst basieren.
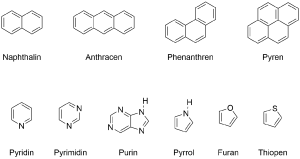
Neben diesen Verbindungen gibt es auch weitere Aromaten, wie beispielsweise die kondensierten bzw. anellierten Aromaten bei denen mehrere Benzen-Ringe aneinandergekettet sind es entstehen dadurch di-, tri- und polycyclische Aromaten, die linear oder verzweigt sein können.
Nicht auf einem Benzen-Grundmolekül basierend existieren die Heteroatomaromaten bei denen ein oder mehr Kohlenstoff-Atome in einem zyklischen System durch ein anderes Atom (Heteroatom) ausgetauscht sind. Dabei muss es sich nicht immer um ein sechsgliedriges System handeln, es können auch kleinere oder größere Ringe aromatisch sein, beziehungsweise anellierte Ringe.
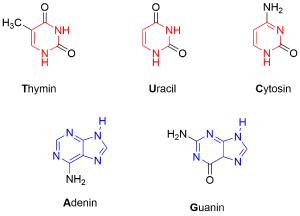
Solche Heteroatomaromaten sind vor allem in biologischen Systemen von Relevanz. So bilden Pyrimidin und Purin die Grundbausteine für die fünf in DNA und RNA verbauten Basen.
Erhöhtes Anforderungsniveau: Vielfalt der Aromaten II - Heteroaromaten
Heteroatomaromaten (Synonym: Heteroaromaten) enthalten neben Kohlenstoff auch Heteroatome wie Sauerstoff, Stickstoff, Schwefel oder Phosphor im Ringgerüst gebunden. Wie bereits erwähnt spielen Heteroaromaten eine wichtige Rolle in biologischen Systemen.
Wir betrachten hier nun mehr die Struktur und elektronischen Eigenschaften zweier wichtiger Gruppen der Heteroaromaten.
A - Elektronenmangel-Aromaten
Um die chemischen Eigenschaften von Elektronenmangel-Aromaten zu beschreiben, betrachten wir uns exemplarisch das Pyridin. Beim Pyridin handelt es sich um einen der Struktur des Benzols ähnlichen Stoff, bei dem jedoch eine CH-Einheit durch ein Stickstoff-Atom ausgetauscht wurde (Azabenzol). Betrachtet man die Orbitalsituation stellt man fest, dass aufgrund der sp2-Hybridisierung des N-Atoms das freie Elektronenpaar in einem solchen sp2-Hybridorbital lokalisiert ist, und das orthogonal dazu stehende pz-Orbital mit einem freien Elektron besetzt ist, wodurch ein π-Elektronensextett entsteht, wie im Benzol auch. Das freie Elektronenpaar hat keinen Einfluss auf das aromatische System, da es sich auf einer anderen Energiestufe befindet.
Betrachten wir uns die Elektronegativität des Stickstoff, so ist diese im Vergleich zum Kohlenstoff größer (EN = 3,0), da Stickstoff in der V. Hauptgruppe steht und Kohlenstoff nur in der IV. Hauptgruppe. Dadurch kommt es zum -I-Effekt (negativer induktiver Effekt) der die Elektronen im gesamten Ringsystem anzieht, wodurch die Elektronendichte hin zum Stickstoff verlagert wird.
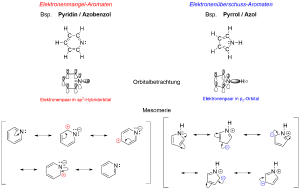
Dies ist auch durch die mesomeren Grenzstrukturen beobachtbar - so kommt eine negative Formalladung immer beim Stickstoff zu liegen, die positive Formalladung allerdings bei einem Kohlenstoff-Atom.
Folge: Der Ring ist weniger nucleophil und wird daher nur sehr schwer in einer elektrophilen Substitution am Aromaten reagieren. Stattdessen ist eine nucleophile Substitution am Aromaten (in einem Additions-Eliminierungs-Mechanismus) bevorzugt, da eine entstehende negative Teilladung im Ring stabilisiert werden kann. Gleichzeitig kann das Pyridin aufgrund des freien, nicht am π-System beteiligten Elektronenpaars als LEWIS-Base reagieren.
B - Elektronenüberschuss-Aromaten
Für die Betrachtung eines Elektronenüberschuss-Aromaten bleiben wir bei einem Stickstoff-haltigen Vertretet, dem Pyrrol. Hierbei handelt es sich um keinen benzoiden Aromaten (sechsgliedrige Benzol-Struktur) sondern um einen aromatischen Fünfring. Aufgrund der Fünfring-Struktur kommt es zu keiner ausgeglichenen Verteilung der formal gesehenen Doppelbindung. Da als Bedingung für die Aromatizität jedoch alle Ringglieder sp2-hybridisiert sein müssen, trägt das Stickstoff-Atom hier nun ein gebundenes Wasserstoff-Atom im Gegensatz zum Stickstoff-Atom im Pyridin, was keinen Wasserstoff gebunden hat. Eben durch die Ausbildung einer σ-Bindung zum H-Atom befindet sich das freie Elektronenpaar des Stickstoffs im pz-Orbital und ist somit Teil des aromatischen Systems. Dadurch wird die Elektronendichte in den Ring geschoben, was auch an den mesomeren Grenzstrukturen wieder zu sehen ist, bei denen die negative Formalladung nun an einem Kohlenstoff-Atom liegt, und die positive dagegen am Stickstoff.
Folge: Der Ring ist stärker nucleophil und geht daher sehr schnell und leicht elektrophile Substitutionen am Aromaten ein. Gleichzeitig lässt sich das H-Atom, welches am Stickstoff gebunden ist leicht abspalten, fungiert somit als BRØNSTED-Säure, da bei Deprotonierung das aromatische System erhalten bleibt.
Übungsaufgaben
Grundlegendes Anforderungsniveau
AFB I/II:
Benzaldehyd kann bereits an Luft schnell zu Benzoesäure reagieren. Stellen Sie das Redox-System für die Reaktion von Benzaldehyd mit Eisen(III)-Ionen auf. Geben Sie in beiden Teilgleichungen für alle Atome die Oxidationszahlen an. Bei den Strukturen kannst du dich an die Abbildungen im Abschnitt Vielfalt der Aromaten orientieren.
AFB III:
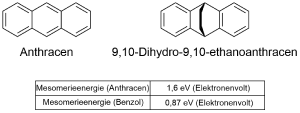
In der nebenstehenden Abbildung werden Ihnen zwei Moleküle gezeigt - Anthracen und 9,10-Dihydro-9,10-ethanoanthracen. Äußern Sie eine Vermutung zur thermodynamischen Stabilität beider Verbindungen unter Nutzung der in der Abbildung gegebenen Werte für die Mesomerieenergie, sowie ihrer Kenntnisse zur Mesomerie.
TIPP: Betrachten Sie sich die Anzahl der Elektronen jedes einzelnen Rings.
Erhöhtes Anforderungsniveau
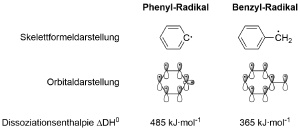
Äußern Sie sich zur Stabilität des Phenyl-Radikals im Vergleich zum Benzyl-Radikal. Nutzen Sie dazu die Informationen, die Ihnen die nebenstehende Abbildung gibt.