Redoxreaktionen: Unterschied zwischen den Versionen
DiMedS (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
FFunke (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| (10 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 18: | Zeile 18: | ||
=Aufstellen von einfachen Redoxgleichungen= | =Aufstellen von einfachen Redoxgleichungen= | ||
Eine häufige Aufgabenstellung wird in Zukunft wird sein: "Stelle eine Redoxgleichung ausgehend von Teilgleichungen auf".<br> | Eine häufige Aufgabenstellung wird in Zukunft wird sein: "Stelle eine Redoxgleichung ausgehend von Teilgleichungen auf".<br> | ||
Für eine einfache Redoxreaktion (wie wir sie in Klasse 8 behandeln) kannst du dir einen einfachen Algorithmus angewöhnen, mit dem | Für eine einfache Redoxreaktion (wie wir sie in Klasse 8 behandeln) kannst du dir einen einfachen Algorithmus angewöhnen, mit dem dies schnell und unkomplziert funktioniert. | ||
Dieser wird dir anhand eines Beispiels nun erklärt. | Dieser wird dir anhand eines Beispiels nun erklärt. | ||
| Zeile 42: | Zeile 42: | ||
| '''Oxidation:''' Zn → Zn<sup>2+</sup> + 2 e<sup>-</sup> | | '''Oxidation:''' Zn → Zn<sup>2+</sup> + 2 e<sup>-</sup> | ||
|} | |} | ||
*'''4. Schritt:''' Schreibe die Reaktionsgleichung für die Reduktion in Ionenschreibweise auf. | |||
{| class="wikitable" | |||
|- | |||
| '''Reduktion:''' I<sub>2</sub> + 2 e<sup>-</sup> → 2 I<sup>-</sup> | |||
|} | |||
*'''5. Schritt:''' Fasse die beiden Teilgleichungen zusammen, indem du alles was in den beiden Teilgleichungen vor bzw. hinter dem Reaktionspfeil steht, vor bzw. hinter einen neuen Reaktionspfeil schreibst. | |||
{| class="wikitable" | |||
|- | |||
| '''Zusammenfassen:''' I<sub>2</sub> + 2 e<sup>-</sup> + Zn → 2 I<sup>-</sup> + Zn<sup>2+</sup> + 2 e<sup>-</sup> | |||
|} | |||
*'''6. Schritt:''' Kürze die Elektronen aus der Reaktion und fasse ggf. Ionen zur einer Salzformel zusammen (nur bei Reaktionen, die nicht in wässriger Lösung vorliegen). Bezeichen die neu entstandene Reaktion als Redoxreaktion. | |||
[[Datei:Abbildung1.PNG|mini|Abbildung 1: Aufschreiben des Algorithmus]] | |||
{| class="wikitable" | |||
|- | |||
| '''Redoxreaktion:''' I<sub>2</sub> + Zn → ZnI<sub>2</sub> | |||
|} | |||
'''Hinweis 1:''' Du musst die Teilgleichungen wenn nötig noch so ausgleichen, dass die Anzahl der abgegebenen Elektronen mit der Anzahl der aufgenommenen Elektronen übereinstimmt.<br> | |||
'''Hinweis 2:''' Schritt 2 und 5 müssen nicht unbedingt mit aufgeschrieben werden, können aber für dich hilfreich sein. In der Abbildung 1 siehts du das Minumum und die Form, was wie aufgeschrieben werden muss. | |||
=Redoxreaktionen im Alltag= | =Redoxreaktionen im Alltag= | ||
[[Datei:Velp-thermitewelding-1.jpg|mini|Abbildung 2: Thermitverfahren]] | |||
* Eine Redoxreaktion die uns sehr häufig in unserem Alltag begegnet, ist die '''Verbrennung'''. Dabei bildet stets ''Sauerstoff das Reduktionsmittel''. Charakteristisch für eine Verbrennung ist die (teilweise hohe) Abgabe von [[Energie]]. Daher können einige Verbrennungsreaktionen, so zum Beispiel die Verbrennung von Diesel und Benzin, eingesetzt werden um [[Arbeit]] zu leisten, in diesem Fall zum Antrieb von Autos oder LKWs. | |||
* Eine Redoxreaktion die für uns Menschen lebenswichtig ist, ist die '''[[Photosynthese]]'''. Bei dieser produzieren grüne Pflanzen aus Kohlenstoffdioxid und Wasser (unter Lichteinfluss), Traubenzucker (glucose) und Sauerstoff. Letzterer ist für unser Leben existenziell. | |||
{| class="wikitable" | |||
|- | |||
|6 CO<sub>2</sub> + 6 H<sub>2</sub>O → C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> <small>(Glucose)</small> + 6 H<sub>2</sub>O | |||
|} | |||
* Zum Schweißen von Eisenbahnschienen nutzt man ebenfalls eine Redoxreaktion aus. Hierbei wird Aluminium als Reduktionsmittel eingesetzt um aus Eisen(III)-oxid festes Eisen zu gewinnen, welches dann die Schienen verschweißt. Eine solche Mischung aus Aluminium und Eisen(III)-oxid wird Thermit genannt, desahlb spricht man hier vom '''Thermitverfahren''' (siehe Abbildung 2). | |||
{| class="wikitable" | |||
|- | |||
|2 Al + Fe<sub>2</sub>O<sub>3</sub> → Al<sub>2</sub>O<sub>3</sub> + 2 Fe | |||
|} | |||
=Übungsaufgabe= | =Übungsaufgabe= | ||
Die Verbrennung von Magnesium ist eine sehr stark exotherme (Energie freiwerdende) Reaktion. | |||
#Schaue dir dazu folgendes [https://www.youtube.com/watch?v=wLmGnAeuseE Video] von dem Experiment dazu an und notiere kurz deine Beobachtung. | |||
#Stelle für diese Reaktion die Redoxgleichung ausgehend von den Teilgleichungen für Oxidation und Reduktion auf. | |||
#Wofür kann man das entstandene Produkt nutzen? Nenne mindestens eine Anwendung davon. | |||
[[Kategorie: Chemie]] | |||
Aktuelle Version vom 28. Juni 2021, 14:26 Uhr
Redoxreaktionen sind chemische Reaktionen, bei denen eine Elektronenübertragung von einem Stoff A auf einen Stoff B erfolgt.
Sie finden stets in zwei Teilschritten statt, die Oxidation und Reduktion genannt werden. Diese bedingen sich gegenseitig, dass heißt sie treten nur zusammen auf.
Ablauf der Redoxreaktion
Bei der Oxidation gibt ein Stoff A Elektronen ab (Fachbegriff: Elektronendonator). Man sagt: "Der Stoff A wird oxidiert". Die allgemeine Reaktionsgleichung lautet:
| A → A+ + e- |
Bei der Reduktion nimmt ein Stoff B Elektronen auf (Fachbegriff: Elektronenakzeptor). Man sagt: "Der Stoff B wird reduziert". Die allgemeine Reaktionsgleichung lautet:
| B + e- → B- |
Der Stoff A besitzt die Eigenschaft, dass er reduzierend wirkt, d.h. er bewirkt die Reduktion von Stoff B. Man nennt ihn deshalb Reduktionsmittel (Abkürzung: RM).
Der Stoff B besitzt die Eigenschaft, dass er oxidierend wirkt, d.h. er bewirkt die Oxidation von Stoff A. Mann nennt ihn deshalb Oxidationsmittel (Abkürzung: OM)
Aufstellen von einfachen Redoxgleichungen
Eine häufige Aufgabenstellung wird in Zukunft wird sein: "Stelle eine Redoxgleichung ausgehend von Teilgleichungen auf".
Für eine einfache Redoxreaktion (wie wir sie in Klasse 8 behandeln) kannst du dir einen einfachen Algorithmus angewöhnen, mit dem dies schnell und unkomplziert funktioniert.
Dieser wird dir anhand eines Beispiels nun erklärt.
Algorithmus
- 0. Schritt: Aufgabenstellung durchlesen
| Beispiel Ein wenig Zinkpulver und ein wenig festes Iod werden vermengt und mit ein paar Tropfen Wasser (wirkt als Katalysator) zur Reaktion gebracht. Es ensteht dabei festes Zink(II)-iodid (Video vom Experiment auf YouTube). Stelle die Redoxgleichung für diese Reaktion auf, gehe dabei von den Teilgleichungen für Oxidation und Reduktion aus. |
- 1. Schritt: Schreibe zunächst die Wortgleichung für die Reaktion auf.
| Wortgleichung: Iod + Zink → Zink(II)-iodid |
- 2. Schritt: Überlege dir, welcher Ausgangsstoff oxidiert wird und welcher reduziert wird.
| Zink wird oxidiert (Zink zu Zink(II)-Ionen durch Elektronenabgabe), Iod wird reduziert (Iod zu Iodid-Ionen durch Elektronenaufnahme) |
- 3. Schritt: Schreibe die Reaktionsgleichung für die Oxidation in Ionenschreibweise auf.
| Oxidation: Zn → Zn2+ + 2 e- |
- 4. Schritt: Schreibe die Reaktionsgleichung für die Reduktion in Ionenschreibweise auf.
| Reduktion: I2 + 2 e- → 2 I- |
- 5. Schritt: Fasse die beiden Teilgleichungen zusammen, indem du alles was in den beiden Teilgleichungen vor bzw. hinter dem Reaktionspfeil steht, vor bzw. hinter einen neuen Reaktionspfeil schreibst.
| Zusammenfassen: I2 + 2 e- + Zn → 2 I- + Zn2+ + 2 e- |
- 6. Schritt: Kürze die Elektronen aus der Reaktion und fasse ggf. Ionen zur einer Salzformel zusammen (nur bei Reaktionen, die nicht in wässriger Lösung vorliegen). Bezeichen die neu entstandene Reaktion als Redoxreaktion.
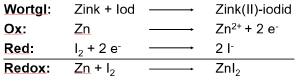
| Redoxreaktion: I2 + Zn → ZnI2 |
Hinweis 1: Du musst die Teilgleichungen wenn nötig noch so ausgleichen, dass die Anzahl der abgegebenen Elektronen mit der Anzahl der aufgenommenen Elektronen übereinstimmt.
Hinweis 2: Schritt 2 und 5 müssen nicht unbedingt mit aufgeschrieben werden, können aber für dich hilfreich sein. In der Abbildung 1 siehts du das Minumum und die Form, was wie aufgeschrieben werden muss.
Redoxreaktionen im Alltag

- Eine Redoxreaktion die uns sehr häufig in unserem Alltag begegnet, ist die Verbrennung. Dabei bildet stets Sauerstoff das Reduktionsmittel. Charakteristisch für eine Verbrennung ist die (teilweise hohe) Abgabe von Energie. Daher können einige Verbrennungsreaktionen, so zum Beispiel die Verbrennung von Diesel und Benzin, eingesetzt werden um Arbeit zu leisten, in diesem Fall zum Antrieb von Autos oder LKWs.
- Eine Redoxreaktion die für uns Menschen lebenswichtig ist, ist die Photosynthese. Bei dieser produzieren grüne Pflanzen aus Kohlenstoffdioxid und Wasser (unter Lichteinfluss), Traubenzucker (glucose) und Sauerstoff. Letzterer ist für unser Leben existenziell.
| 6 CO2 + 6 H2O → C6H12O6 (Glucose) + 6 H2O |
- Zum Schweißen von Eisenbahnschienen nutzt man ebenfalls eine Redoxreaktion aus. Hierbei wird Aluminium als Reduktionsmittel eingesetzt um aus Eisen(III)-oxid festes Eisen zu gewinnen, welches dann die Schienen verschweißt. Eine solche Mischung aus Aluminium und Eisen(III)-oxid wird Thermit genannt, desahlb spricht man hier vom Thermitverfahren (siehe Abbildung 2).
| 2 Al + Fe2O3 → Al2O3 + 2 Fe |
Übungsaufgabe
Die Verbrennung von Magnesium ist eine sehr stark exotherme (Energie freiwerdende) Reaktion.
- Schaue dir dazu folgendes Video von dem Experiment dazu an und notiere kurz deine Beobachtung.
- Stelle für diese Reaktion die Redoxgleichung ausgehend von den Teilgleichungen für Oxidation und Reduktion auf.
- Wofür kann man das entstandene Produkt nutzen? Nenne mindestens eine Anwendung davon.