Atom: Unterschied zwischen den Versionen
DiMedS (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
DiMedS (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 16: | Zeile 16: | ||
=Masse eines Atoms= | =Masse eines Atoms= | ||
Die Masse eines Atoms kann mithilfe der Teilchenzahl, beziehungsweise der Stoffmenge einer bekannten Masse ermittelt werden. | Die Masse eines Atoms kann mithilfe der Teilchenzahl, beziehungsweise der Stoffmenge einer bekannten Masse ermittelt werden<ref>(vgl. Unbekannt, 2017)</ref>. | ||
Dabei befindet sich etwa 99,99% der atomaren Masse im Kern selbst. Die Kernhülle ist also deutlich leichter als der Atomkern. | Dabei befindet sich etwa 99,99% der atomaren Masse im Kern selbst. Die Kernhülle ist also deutlich leichter als der Atomkern. | ||
Dies kann mit dem Verhältnis einer Büroklammer zu einem fast 100 kg schweren Menschen verglichen werden. | Dies kann mit dem Verhältnis einer Büroklammer zu einem fast 100 kg schweren Menschen verglichen werden. | ||
| Zeile 25: | Zeile 25: | ||
==Das rutherfordsche Atommodell== | ==Das rutherfordsche Atommodell== | ||
Im Jahr 1911 entwickelte der britische Physiker [[Ernest Rutherford]] das [[Rutherfordsche Atommodell]], auch genannt [[Planetenmodell]]. Dieses besagt, dass die [[Elektronen]] auf elliptischen Bahnen um einen positiv geladenen [[Atomkern]] kreisen. Dabei kompensieren sich die positiven Ladungen des [[Atomkerns]] und die negativen Ladungen der [[Elektronen]], wodurch das [[Atom]] nach außen hin neutral ist. | Im Jahr 1911 entwickelte der britische Physiker [[Ernest Rutherford]] das [[Rutherfordsche Atommodell]], auch genannt [[Planetenmodell]]. Dieses besagt, dass die [[Elektronen]] auf elliptischen Bahnen um einen positiv geladenen [[Atomkern]] kreisen. Dabei kompensieren sich die positiven Ladungen des [[Atomkerns]] und die negativen Ladungen der [[Elektronen]], wodurch das [[Atom]] nach außen hin neutral ist <ref>(vgl. Meyer & Schmidt, 2003, S. 389)</ref>. | ||
==Das bohrsche Atommodell== | ==Das bohrsche Atommodell== | ||
Zwei Jahre nach der Entdeckung von [[Ernest Rutherford]] erstellte der dänische Physiker [[Niels Bohr]] im Jahr 1913 eine Weiterentwicklung des [[rutherfordschen Atommodells]], welche auch als [[bohrsche Postulate]] bezeichnet werden. Hierbei verband er das [[Kern-Hülle-Modell]] mit [[Quantenvorstellungen]]. Seinen Angaben zufolge bewegen sich die [[Elektronen]] auf kreisförmigen Bahnen um den positiv geladenen [[Atomkern]]. | Zwei Jahre nach der Entdeckung von [[Ernest Rutherford]] erstellte der dänische Physiker [[Niels Bohr]] im Jahr 1913 eine Weiterentwicklung des [[rutherfordschen Atommodells]], welche auch als [[bohrsche Postulate]] bezeichnet werden. Hierbei verband er das [[Kern-Hülle-Modell]] mit [[Quantenvorstellungen]]. Seinen Angaben zufolge bewegen sich die [[Elektronen]] auf kreisförmigen Bahnen um den positiv geladenen [[Atomkern]] <ref>(vgl. Meyer & Schmidt, 2003, S. 389-99)</ref>. | ||
=Symbolschreibweise eines Atoms= | =Symbolschreibweise eines Atoms= | ||
| Zeile 61: | Zeile 61: | ||
=Quellenverzeichnis= | =Quellenverzeichnis= | ||
Meyer, | Meyer, L. & G.-D. Schmidt. (2003). ''Abitur Physik. Basiswissen Schule.'' Paetec Verlag für Bildungsmedien Berlin. | ||
Unbekannt.(2017). ''Existenz von Atomen. Aufbau der Materie aus Atomen.'' Physikunterricht-online. 15.04.2021, https://physikunterricht-online.de/jahrgang-12/existenz-von-atomen/. | Unbekannt.(2017). ''Existenz von Atomen. Aufbau der Materie aus Atomen.'' Physikunterricht-online. 15.04.2021, https://physikunterricht-online.de/jahrgang-12/existenz-von-atomen/. | ||
[[Kategorie:A-Z]] | [[Kategorie:A-Z]] | ||
Version vom 15. April 2021, 12:23 Uhr
Definition von Atomen
Atome sind die einzelnen kleinen Bausteine aus denen ein Stoff besteht. Atome haben einen Atomkern und eine Atomhülle. In der Atomhülle befinden sich die Elektronen und im Kern die Protonen und Neutronen.
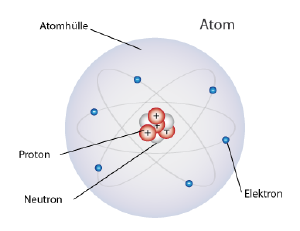
Einfacher Atomaufbau
Ein Atom besteht aus einer Atomhülle mit negativ geladenen Elektronen und einem Atomkern, in welchem sich positiv geladene Protonen und neutrale, ungeladene Neutronen befinden.
Größe eines Atoms
Der Durchmesser von Atomen liegt in einem Bereich von zehnmillionstel Millimetern (10-10m). Wenn das Atom einen Radius von der Größe des Eifelturms hätte, wäre der Atomkern so groß wie eine Kirsche. Bezogen auf die Stadt Leipzig entspricht dies der Größe des Augustusplatzes, in dessen Mitte ein Kirschkern liegt.
Masse eines Atoms
Die Masse eines Atoms kann mithilfe der Teilchenzahl, beziehungsweise der Stoffmenge einer bekannten Masse ermittelt werden[2]. Dabei befindet sich etwa 99,99% der atomaren Masse im Kern selbst. Die Kernhülle ist also deutlich leichter als der Atomkern. Dies kann mit dem Verhältnis einer Büroklammer zu einem fast 100 kg schweren Menschen verglichen werden.
Atommodelle
Über Jahrzehnte hinweg haben atomphysikalische Forschungen zur Entwicklung und Formulierung verschiedener, moderner Atommodelle geführt.
Das rutherfordsche Atommodell
Im Jahr 1911 entwickelte der britische Physiker Ernest Rutherford das Rutherfordsche Atommodell, auch genannt Planetenmodell. Dieses besagt, dass die Elektronen auf elliptischen Bahnen um einen positiv geladenen Atomkern kreisen. Dabei kompensieren sich die positiven Ladungen des Atomkerns und die negativen Ladungen der Elektronen, wodurch das Atom nach außen hin neutral ist [3].
Das bohrsche Atommodell
Zwei Jahre nach der Entdeckung von Ernest Rutherford erstellte der dänische Physiker Niels Bohr im Jahr 1913 eine Weiterentwicklung des rutherfordschen Atommodells, welche auch als bohrsche Postulate bezeichnet werden. Hierbei verband er das Kern-Hülle-Modell mit Quantenvorstellungen. Seinen Angaben zufolge bewegen sich die Elektronen auf kreisförmigen Bahnen um den positiv geladenen Atomkern [4].
Symbolschreibweise eines Atoms
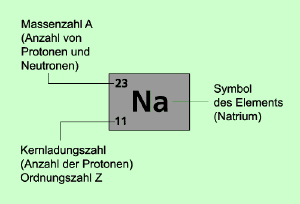
Massenzahl: A = Z + N (Protonenzahl = Z) (Neutronenzahl = N)
Ordnungszahl = Protonenzahl
Elektronenzahl = Protonenzahl bei einem Atom
Übungsaufgaben
Welche Massenzahl und wie viele Neutronen, Protonen und Elektronen haben diese Elemente? Nutze das Periodensystem der Elemente!
| Element | A | Z | N | |
|---|---|---|---|---|
| a) | He | |||
| b) | 27 | 13 | ||
| c) | Pb | |||
| d) | Ba | |||
| e) | Li-7 |
Quellenverzeichnis
Meyer, L. & G.-D. Schmidt. (2003). Abitur Physik. Basiswissen Schule. Paetec Verlag für Bildungsmedien Berlin.
Unbekannt.(2017). Existenz von Atomen. Aufbau der Materie aus Atomen. Physikunterricht-online. 15.04.2021, https://physikunterricht-online.de/jahrgang-12/existenz-von-atomen/.
- ↑ http://www.kwk-statt-akw.de/kwk-statt-akw_akw-infos.html
- ↑ (vgl. Unbekannt, 2017)
- ↑ (vgl. Meyer & Schmidt, 2003, S. 389)
- ↑ (vgl. Meyer & Schmidt, 2003, S. 389-99)
- ↑ https://www.lernhelfer.de/schuelerlexikon/physik/artikel/ordnungszahl-und-massenzahl#