Aggregatzustand
Der Aggregatzustand eines Stoffes beschreibt seinen druck- und temperaturabhängigen Zustand. Dieser kann anhand der Teilchenbewegung und des -abstands des Stoffes festgemacht werden kann. Die drei klassischen Aggregatzustände sind fest, flüssig und gasförmig.[1]
Eigenschaften der Aggregatzustände
Körper mit unterschiedlichen Aggregatzuständen unterscheiden sich in ihrem äußeren Form- und Volumenverhalten. Auf der Teilchenebene unterscheiden sich die Aggregatzustände in der Bewegung der Teilchen und der Kräfte zwischen ihnen.[2]
Fest
Körper im festen Zustand haben immer eine bestimmte Form und ein bestimmtes Volumen. Die Teilchen von Festkörpern liegen eng beieinander und haben feste Plätze, um die sie Schwingen. Zwischen ihnen wirken starke Anziehungskräfte.[3]
Flüssig
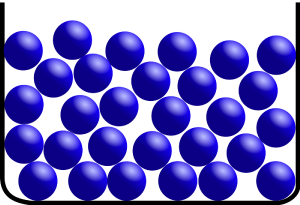
Körper im flüssigen Zustand haben keine bestimmte Form, aber ein bestimmtes Volumen. Flüssigkeiten passen sich der Form ihres Gefäßes an. Die Teilchen der Flüssigkeiten haben keinen festen Platz, sind gegeneinander verschiebbar und bewegen sich unregelmäßig. Die Anziehungskräfte zwischen den Teilchen sind kleiner als bei Festkörpern und die Abstände voneinander sind größer.[5][6]
Gasförmig
Gase haben keine feste Form und passen sich der Form ihres Gefäßes an. Ihr Volumen ist veränderlich und nimmt immer den gesamten zur Verfügung stehenden Raum ein. Die Teilchen der Gase bewegen sich schnell und frei im Raum. Sie sind dabei unregelmäßig mit großen Abständen angeordnet und stoßen gegen die Raumwände, welche den Druck des Gases bestimmen. Zwischen den Teilchen wirken nur sehr schwache Kräfte. [7]
Aggregatzustandsänderung
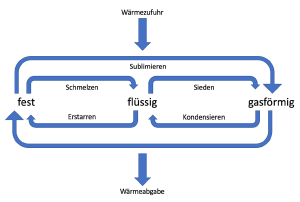
Der Aggregatzustand eines Körpers kann sich durch Zufuhr oder Abgabe von Wärme ändern. Während der Umwandlung des Stoffes ändert sich seine Temperatur nicht, seine thermische Energie und häufig das Volumen jedoch schon. Die Temperatur, bei der eine Aggregatzustandsänderung stattfindet, ist stoff- und druckabhängig.[8]
Schmelzen
Durch Wärmezufuhr gehen Festkörper in den flüssigen Aggregatzustand über. Dieser Vorgang nennt sich Schmelzen. Er findet bei einer konkreten Temperatur statt, der stoffspezifischen Schmelztemperatur. Die Schmelztemperatur ist umso niedriger, je höher der Druck ist. Das Volumen der meisten Festkörper ist kleiner als das des flüssigen Körpers. Eine Ausnahme bildet dabei Wasser aufgrund seiner Dichteanomalie.[9]
Erstarren
Durch Wärmeabfuhr gehen Flüssigkeiten wieder in den festen Aggregatzustand über. Dieser Vorgang nennt sich Erstarren. Auch das Erstarren findet bei einer konkreten Temperatur statt, der Erstarrungstemperatur. Die Erstarrungstemperatur entspricht der Schmelztemperatur.[10]
Sieden
Durch Wärmezufuhr gehen Flüssigkeiten in den gasförmigen Aggregatzustand über. Dieser Vorgang nennt sich Sieden bzw. Verdampfen. Dies findet bei der stoffspezifischen Siedetemperatur statt. Die Siedetemperatur ist umso höher, je größer der Druck ist. [11]
Kondensieren
Durch Wärmeabfuhr gehen Gase in den flüssigen Aggregatzustand über. Dieser Vorgang nennt sich Kondensieren. Dies findet bei der stoffspezifischen Kondensationstemperatur statt, welche gleich der Siedetemperatur ist.
Sublimieren
Als Sublimieren bezeichnet man den Vorgang, bei dem Festkörper unmittelbar in den gasförmigen Aggregatzustand übergehen.[12]
Resublimieren
Als Resumblimieren bezeichnet man den Vorgang, bei dem Gase unmittelbar in den festen Aggregatzustand übergehen.
Übungsaufgabe
Finde für jede Aggregatszustandsänderung ein Beispiel aus deinem Alltag.
- ↑ vgl. http://www.biologie-schule.de/aggregatzustand.php abgerufen am 03.04.2021
- ↑ vgl. Meyer, Lothar/ Gerd-Dietrich Schmidt: Duden. Basiswissen Schule. Physik: 5. bis 10. Klasse, 4., neu bearbeitete Auflage, Berlin, Deutschland: Duden Schulbuchverlag, 2010, S. 74
- ↑ vgl. Meyer/Schmidt, 2010, S. 75
- ↑ http://de.wikipedia.org/wiki/Datei:Teilchenmodell_Fluessigkeit.svg
- ↑ vgl. Meyer/Schmidt, 2010, S.75
- ↑ vgl. https://studyflix.de/chemie/aggregatzustande-2011 abgerufen am 03.04.2021
- ↑ vgl. https://studyflix.de/chemie/aggregatzustande-2011 abgerufen am 03.04.2021
- ↑ vgl. Meyer/Schmidt, 2010, S. 177
- ↑ vgl. Meyer/Schmidt, 2010, S. 177-179
- ↑ vgl. Meyer/Schmidt, 2010, S. 177-179
- ↑ vgl. Meyer/Schmidt, 2010, S. 179-181
- ↑ vgl. Meyer/Schmidt, 2010, S. 181