Chemische Bindungen
Chemische Bindungen
Es gibt verschiedene Möglichkeiten wie die einzelnen Atome oder Ionen innerhalb einer chemischen Verbindung zusammengehalten werden. Die chemischen Bindungen sind elektrostatische Anziehungskräfte oder Wechselwirkungen von Elektronen. Daraus ergeben sich drei unterschiedliche Bindungsarten: die Ionenbindung, die Metallbindung und die Atombindung. Kennt man die Bindungsart einer Verbindung, lassen sich daraus einige Eigenschaften der Verbindung schließen.
Ionenbindung
Merkmale
- Die Ionenbindung ist eine Bindug zwischen positiv geladenen Kationen und negativ geladenen Anionen aufgrund großer elektrostatischer Anziehungskräfte.
- Die Differenz der Elektronegativitätswerte (EN) ist größer als 1,7. (Richtwert[1])
Bildung
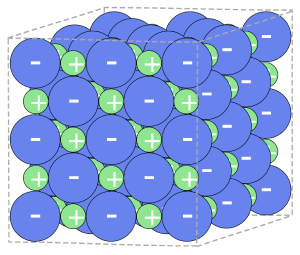
- Es wird ein Ionenkristall gebildet.
- Die Bildung der entsprechenden Ionen erfolgt nach der Oktettregel.
Elektronendonator: Metallatome -> bilden Kationen Elektronenakzeptor: Nichtmetallatome -> bilden Anionen
- Die Bildung von Ionenkristallen aus den Elementen ist eine Redoxreaktion.
Eigenschaften
- Ionenbindungen haben eine hohe Schmelz- und Siedetemperatur. Diese entstehen durch die elektrostatischen Anziehungskräfte der geladenen Ionen.
- Verbindungen mit Ionenbindungen sind löslich in polaren Lösungsmitteln, wie z.B. Wasser, da sie selbst polar sind.
- Ionenbindungen können im festen Zustand keinen elektrischen Strom leiten, aber sie leiten elektrischen Strom als Schmelze oder Lösung.
- Dabei sind die Ionen die Ladungsträger. Es findet ein gerichtetes Wandern statt.
Hart aber spröde
- Der Ionenkristall ist sehr stabil, da die Anziehungskräfte zwischen unterschiedlich geladenen Ionen sehr hoch ist.
- Bei Einwirken einer externen Kraft zerfällt dennoch der Ionenkristall, da Ionen mit derselben Ladung aufeinandertreffen und sich gegenseitig abstoßen.
Metallbindung
Merkmale
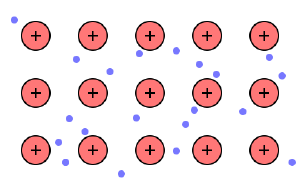
- Die Metallbindung ist eine Bindung zwischen positiv geladenen Metallionen und negativ geladenen Elektronen aufgrund großer elektrostatischer Anziehungskräfte.
- Die Metallionen sind dabei auf festen Gitterplätzen angeordnet.
- Die Elektronen sind delokalisiert, also freibeweglich.
Eigenschaften
- Freibewegliche Elektronen können den Strom vom Pluspol zum Minuspol transportieren. Dadurch können Metalle den elektrischen Strom leiten.
- Bei Wärme nimmt die elektrische Leitfähigkeit ab, da die Metallionen anfangen zu schwingen und dadurch den Elektronenfluss behindern. #
Wärmeleitfähigkeit
- Energie, in Form von Wärme, kann leicht von den Elektronen aufgenommen werden und wird in Bewegungsenergie umgewandelt und ins Innere des Metalls transportiert. Dadurch sind Metalle wärmeleitfähig.