Säure-Base-Reaktion
Definition nach Brønstedt
Eine Säure-Base-Reaktion ist eine chemische Reaktion, bei denen Protonen des Wassers zwischen Molekülen oder deren Ionen übertragen werden. Säuren sind Protonen-Donatoren, sie geben also die H+ Ionen ab. Basen sind Protonen-Akzektptoren, sie nehmen die abgegebenen Ionen auf. Eine Säure-Base-Reaktion ist demzufolge eine H+ Übertragungsreaktion. [1]
Reaktionsmechanismus
Die Hauptreaktion sieht wie folgt aus[2]:
HA + B ⇌ A- + HB+
- Säure + Base steht im Gleichgewicht zur konjugierten (korrespondierenden) Base + konjugierten (korrespondierenden) Säure
Protolyse
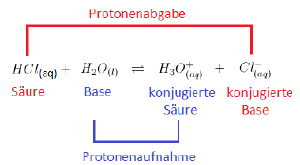
Säure-Base-Reaktionen lassen sich in zwei Teilreaktionen zerlegen, die beide als Protolyse bezeichnet werden: Protonenabgabe: HCl ⇌ Cl- + H+
Beim Auflösen von Chlorwasserstoffgas in Wasser entsteht Salzsäure. Hierbei dient der Ampholyt Wasser als Base.
Protonenaufnahme: H2O + H+ ⇌ H3O+
Das freie H+ wird von H2O aufgenommen, das damit zu H3O+ wird.
Übung
Ammoniak reagiert mit dem Ampholyt Wasser, das jetzt als Säure fungiert, zu einer basischen Lösung.
Stelle die Reaktionsgleichungen auf und zeichne die Protonenabgabe und Protonenaufnahme mit Pfeilen ein.