Basen: Unterschied zwischen den Versionen
DiMedS (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
DiMedS (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| (14 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Unter Basen lassen sich alle Verbindungen, die in wässriger Lösung in der Lage sind | Unter Basen lassen sich alle Verbindungen, die in wässriger Lösung in der Lage sind Hydroxid-Ionen zu bilden, auffassen. | ||
Dabei können die | Dabei können die Hydroxid-Ionen, die Protonen von einer Säure unter Bildung eines Wassermoleküls übernehmen und damit schlussfolgernd die [[Säuren|Säure]] neutralisieren. Dadurch lassen sich Basen als Gegenstück von [[Säuren]] beschreiben. | ||
=Definition= | =Definition= | ||
== | ==Nach Arrhenius== | ||
Basen sind Stoffe, die in wässriger Lösung zu frei beweglich elektrisch positiv geladenen Metallionen und frei beweglich elektrisch negativ geladenen | Basen sind Stoffe, die in wässriger Lösung zu frei beweglich elektrisch positiv geladenen Metallionen und frei beweglich elektrisch negativ geladenen Hydroxid-Ionen dissoziieren. <ref>vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2015), Anorganische Chemie, 9. Auflage, Berlin, Seite 343</ref> | ||
== | ==Nach Brønsted== | ||
Nach Brønsted besteht das Wesen einer [[Säuren|Säure]]-Base-Reaktion, also einer Protolyse, im Übergang von Protonen von einer Säure zu einer Base. Basen spielen dabei die Rolle des Protonenakzeptors. | Nach [[Brønsted]] besteht das Wesen einer [[Säuren|Säure]]-Base-Reaktion, also einer [[Protolyse]], im Übergang von Protonen von einer [[Säuren|Säure]] zu einer Base. Basen spielen dabei die Rolle des Protonenakzeptors. <ref>vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2015), Anorganische Chemie, 9. Auflage, Berlin, Seite 343</ref> | ||
=Eigenschaften von Basen <ref> vgl. https://www.biologie-schule.de/basen.php </ref>= | |||
- Basen sind ätzend | |||
- Basen schmecken bitter (Bitte nicht probieren!) | |||
- organisches Material wird von Basen aufgelöst | |||
- Basen fühlen sich ölig/seifig an. | |||
- die meisten Basen sind wasserlöslich | |||
- Säuren neutralisieren Basen bzw. Laugen | |||
- Universalindikator färbt sich violett/blau | |||
- Basen verfügen über einen pH-Wert von ca. 7,5 - 14 | |||
- Basen sind elektrisch leitfähig | |||
=Säure-Base-Paare= | =Säure-Base-Paare= | ||
Säuren und konjugierte Basen bilden zusammen ein Säure-Base-Paar. | Säuren und konjugierte Basen bilden zusammen ein Säure-Base-Paar. | ||
Säure ⇌ Base + Proton | Säure ⇌ Base + Proton | ||
Die Abspaltung von Protonen kann jedoch nicht als isolierte Reaktion erfolgen, sondern muss mit einer zweiten Reaktion kombiniert werden, die die Protonen verbraucht. Ursache hierfür ist, das freie Protonen in gewöhnlicher Materie nicht existieren können. In wässrigen Lösungen lagern sich die Protonen an Wassermoleküle an, die als Base wirken. Durch die Aufnahme eines Protons entsteht dabei die Säure Hydroniumion. <ref>vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. ( | |||
Die Abspaltung von Protonen kann jedoch nicht als isolierte Reaktion erfolgen, sondern muss mit einer zweiten Reaktion kombiniert werden, die die Protonen verbraucht. Ursache hierfür ist, das freie Protonen in gewöhnlicher Materie nicht existieren können. In wässrigen Lösungen lagern sich die Protonen an Wassermoleküle an, die als Base wirken. Durch die Aufnahme eines Protons entsteht dabei die Säure Hydroniumion. <ref>vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2015), Anorganische Chemie, 9. Auflage, Berlin, Seite 344</ref> | |||
[[Datei:Formel.png.png|mini|frame|left|Reaktionsgleichung Säure-Base-Paar]] | [[Datei:Formel.png.png|mini|frame|left|Reaktionsgleichung Säure-Base-Paar]] | ||
| Zeile 41: | Zeile 62: | ||
=Wichtige Basen= | |||
==Natriumhydroxid NaOH== | |||
[[Natriumhydroxid]] ist eine weiße, kristalline Substanz, die auch als Natronlauge bekannt ist. Diese Verbindung wirkt ätzend auf Haut, Schleimhäute und Augen. [[Natriumhydroxid]] ist eine [[exotherm|exotherme]] Verbindung, die in Wasser und Alkohol leicht löslich ist. Es ist eine [[hygroskopisch|hygroskopische]] Substanz. | |||
Festes [[Natriumhydroxid]] reagiert auch mit [[Kohlenstoffdioxid]] in der Luft zu [[Natriumcarbonat]], daher sollte es fest verschlossen gelagert werden. <ref>vgl. https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/wichtige-anorganische-basen#</ref> | |||
==Ammoniak NH3== | |||
[[Ammoniak]] ist ein farbloses [[Gas]] und mit einem einem besonders stechendem Geruch und ist leicht wasserlöslich. Die wässrige Lösung reagiert basisch, da die [[Brønsted]]-Base [[Ammoniak]] dem Wasser ein Proton entzieht und damit Hydroxid-Ionen in der Lösung vorliegen: | |||
[[Datei:Ammoniak.png|mini|frame|left|Reaktion Ammoniak mit Wasser]] | |||
[[Ammoniak]] wird ausschließlich nach dem 1913 entwickelten [[Haber-Bosch-Verfahren]] gewonnen und wird bei der Herstellung von Düngemitteln, Kunststoffen und Pflanzenschutzmitteln verwendet.<ref>vgl. https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/wichtige-anorganische-basen#</ref> | |||
=Anwendung= | =Anwendung= | ||
https://learningapps.org/display?v=pw7fqv35a22 | |||
=Verweise= | =Verweise= | ||
[[Kategorie: Chemie]] | [[Kategorie: Chemie]] | ||
Aktuelle Version vom 29. Juli 2022, 07:53 Uhr
Unter Basen lassen sich alle Verbindungen, die in wässriger Lösung in der Lage sind Hydroxid-Ionen zu bilden, auffassen. Dabei können die Hydroxid-Ionen, die Protonen von einer Säure unter Bildung eines Wassermoleküls übernehmen und damit schlussfolgernd die Säure neutralisieren. Dadurch lassen sich Basen als Gegenstück von Säuren beschreiben.
Definition
Nach Arrhenius
Basen sind Stoffe, die in wässriger Lösung zu frei beweglich elektrisch positiv geladenen Metallionen und frei beweglich elektrisch negativ geladenen Hydroxid-Ionen dissoziieren. [1]
Nach Brønsted
Nach Brønsted besteht das Wesen einer Säure-Base-Reaktion, also einer Protolyse, im Übergang von Protonen von einer Säure zu einer Base. Basen spielen dabei die Rolle des Protonenakzeptors. [2]
Eigenschaften von Basen [3]
- Basen sind ätzend
- Basen schmecken bitter (Bitte nicht probieren!)
- organisches Material wird von Basen aufgelöst
- Basen fühlen sich ölig/seifig an.
- die meisten Basen sind wasserlöslich
- Säuren neutralisieren Basen bzw. Laugen
- Universalindikator färbt sich violett/blau
- Basen verfügen über einen pH-Wert von ca. 7,5 - 14
- Basen sind elektrisch leitfähig
Säure-Base-Paare
Säuren und konjugierte Basen bilden zusammen ein Säure-Base-Paar.
Säure ⇌ Base + Proton
Die Abspaltung von Protonen kann jedoch nicht als isolierte Reaktion erfolgen, sondern muss mit einer zweiten Reaktion kombiniert werden, die die Protonen verbraucht. Ursache hierfür ist, das freie Protonen in gewöhnlicher Materie nicht existieren können. In wässrigen Lösungen lagern sich die Protonen an Wassermoleküle an, die als Base wirken. Durch die Aufnahme eines Protons entsteht dabei die Säure Hydroniumion. [4]
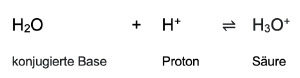
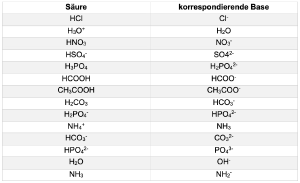
Hier finden sie eine Tabelle mit den Säure-Base-Paaren:
Wichtige Basen
Natriumhydroxid NaOH
Natriumhydroxid ist eine weiße, kristalline Substanz, die auch als Natronlauge bekannt ist. Diese Verbindung wirkt ätzend auf Haut, Schleimhäute und Augen. Natriumhydroxid ist eine exotherme Verbindung, die in Wasser und Alkohol leicht löslich ist. Es ist eine hygroskopische Substanz.
Festes Natriumhydroxid reagiert auch mit Kohlenstoffdioxid in der Luft zu Natriumcarbonat, daher sollte es fest verschlossen gelagert werden. [5]
Ammoniak NH3
Ammoniak ist ein farbloses Gas und mit einem einem besonders stechendem Geruch und ist leicht wasserlöslich. Die wässrige Lösung reagiert basisch, da die Brønsted-Base Ammoniak dem Wasser ein Proton entzieht und damit Hydroxid-Ionen in der Lösung vorliegen:
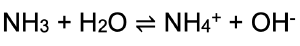
Ammoniak wird ausschließlich nach dem 1913 entwickelten Haber-Bosch-Verfahren gewonnen und wird bei der Herstellung von Düngemitteln, Kunststoffen und Pflanzenschutzmitteln verwendet.[6]
Anwendung
https://learningapps.org/display?v=pw7fqv35a22
Verweise
- ↑ vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2015), Anorganische Chemie, 9. Auflage, Berlin, Seite 343
- ↑ vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2015), Anorganische Chemie, 9. Auflage, Berlin, Seite 343
- ↑ vgl. https://www.biologie-schule.de/basen.php
- ↑ vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2015), Anorganische Chemie, 9. Auflage, Berlin, Seite 344
- ↑ vgl. https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/wichtige-anorganische-basen#
- ↑ vgl. https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/wichtige-anorganische-basen#