Säuren: Unterschied zwischen den Versionen
DiMedS (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
DiMedS (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| (5 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Säuren sind chemische Wasserstoffverbindungen, die ein oder mehrere ihrer gebundenen Protonen (H+) abgeben kann. Diese bilden dann mit Basen, die die Protonen aufnehmen, ein Säure-Base-Paar. | Säuren sind chemische Wasserstoffverbindungen, die ein oder mehrere ihrer gebundenen Protonen (H+) abgeben kann. Diese bilden dann mit [[Basen]], die die Protonen aufnehmen, ein Säure-Base-Paar. Sie kommen vor allem im flüssigen [[Aggregatzustand]] vor. | ||
=Definition= | =Definition= | ||
==Nach Arrhenius== | ==Nach Arrhenius== | ||
Säuren sind Stoffverbindungen, die in wässriger Lösung H+-Ionen abgeben. Mit dieser Vorstellung können zahlreiche Reaktionen in wässriger Lösung veranschaulicht werden. Problematisch ist dabei nur, dass sich als Lösungsmittel auf Wasser beschränkt wird und zum Beispiel Reaktionen in flüssigem Ammoniak oder Alkoholen nicht betrachtet wird. | Säuren sind Stoffverbindungen, die in wässriger Lösung H+-Ionen abgeben. Mit dieser Vorstellung können zahlreiche Reaktionen in wässriger Lösung veranschaulicht werden. Problematisch ist dabei nur, dass sich als Lösungsmittel auf Wasser beschränkt wird und zum Beispiel Reaktionen in flüssigem [[Ammoniak]] oder Alkoholen nicht betrachtet wird. | ||
==Nach Brönsted== | ==Nach Brönsted== | ||
| Zeile 10: | Zeile 10: | ||
=Säure-Base-Paare= | =Säure-Base-Paare= | ||
Wenn Stoffe als Säuren (Protonenabgabe) wirken, dann können die verbleibenden Stoffe die Funktion einer Protonenaufnahme durchführen (als Base wirken). Diese, zu den Säuren zugeordnete, Basen nennt man dann konjugierte Basen. | Wenn Stoffe als Säuren (Protonenabgabe) wirken, dann können die verbleibenden Stoffe die Funktion einer Protonenaufnahme durchführen (als Base wirken). Diese, zu den Säuren zugeordnete, Basen nennt man dann konjugierte Basen. | ||
[[Datei:Säure-Base-paare.png|gerahmt|zentriert|Säure-Base-Paare]] | [[Datei:Säure-Base-paare.png|gerahmt|zentriert|Säure-Base-Paare]] | ||
| Zeile 19: | Zeile 19: | ||
==Salzsäure (HCl)== | ==Salzsäure (HCl)== | ||
Salzsäure ist eine starke, ätzende Säure. Sie reagiert zum Beispiel mit unedlen Metallen unter Wasserstoffentwicklung, mit Metalloxiden und Kalkstein. Der Bedarf an großen Mengen Salzsäure wird aus der Umsetzung von Steinsalz mit Schwefelsäure gedeckt. | [[Salzsäure]] ist eine starke, ätzende Säure. Sie reagiert zum Beispiel mit unedlen [[Metallen]] unter Wasserstoffentwicklung, mit Metalloxiden und Kalkstein. Der Bedarf an großen Mengen Salzsäure wird aus der Umsetzung von Steinsalz mit [[Schwefelsäure]] gedeckt. | ||
==Schwefelsäure (H2SO4)== | ==Schwefelsäure (H2SO4)== | ||
Schwefelsäure ist eine sehr starke und ätzende Säure. Sie zerstört organische Stoffe und zählt zu den wichtigsten Grundstoffen der Chemischen Großindustrie. Dabei wird sie als Elektrolyt in Bleiakkumulatoren, für die Herstellung von Düngemittel, Explosivstoffen und Kunstoffen benötigt. In Mischung mit Salzsäure bildet Schwefelsäure „Königswasser“. | [[Schwefelsäure]] ist eine sehr starke und ätzende Säure. Sie zerstört organische Stoffe und zählt zu den wichtigsten Grundstoffen der Chemischen Großindustrie. Dabei wird sie als Elektrolyt in Bleiakkumulatoren, für die Herstellung von Düngemittel, Explosivstoffen und Kunstoffen benötigt. In Mischung mit [[Salzsäure]] bildet [[Schwefelsäure]] „Königswasser“. | ||
==Kohlensäure (H2CO3)== | ==Kohlensäure (H2CO3)== | ||
Kohlensäure zählt zu den schwachen Säuren. Zur Herstellung wird Kohlendioxid in Wasser gelöst. Bedeutsam sind dabei vor allem die Salze der Kohlensäure (Carbonate). | [[Kohlensäure]] zählt zu den schwachen Säuren. Zur Herstellung wird Kohlendioxid in Wasser gelöst. Bedeutsam sind dabei vor allem die Salze der [[Kohlensäure]] (Carbonate). | ||
=pH-Wert= | =pH-Wert= | ||
[[Datei:pHWerte.jpeg|mini|pH-Werte]] | Der [[pH-Wert]] beschreibt die Säuren- oder Basenwirkung von Flüssigkeiten. Dabei ist der pH-Wert der negative dekadische Logarithmus der Hydroniumionenkonzentration. Der pH-Wert 7 ist der neutrale Punkt. Für einen Wert größer als 7 gilt ein Stoff als basisch und für einen Wert kleiner als 7 ist der Stoff sauer. Je weiter dies vom neutralen Punkt entfernt ist, desto saurer/basischer ist der Stoff.<ref>vgl. Scheipers, P. (Hrsg.) & Biese, V. & Bleyer, U. & Bosse, M. (1993). Chemie- Grundlagen, Anwendungen, Versuche (3., verbesserte Auflage). Wiesbaden: Vieweg (S.152-170) </ref> | ||
[[Datei:PHIndikatoren.jpeg|mini|pH-Indikatoren]] | |||
[[Datei:pHWerte.jpeg|mini|zentriert|pH-Werte]] | |||
=Anwendung= | |||
[[ | https://learningapps.org/watch?v=pn2fqh8d222 | ||
=Verweise= | |||
[[Kategorie: Chemie]] | |||
Aktuelle Version vom 30. März 2022, 11:27 Uhr
Säuren sind chemische Wasserstoffverbindungen, die ein oder mehrere ihrer gebundenen Protonen (H+) abgeben kann. Diese bilden dann mit Basen, die die Protonen aufnehmen, ein Säure-Base-Paar. Sie kommen vor allem im flüssigen Aggregatzustand vor.
Definition
Nach Arrhenius
Säuren sind Stoffverbindungen, die in wässriger Lösung H+-Ionen abgeben. Mit dieser Vorstellung können zahlreiche Reaktionen in wässriger Lösung veranschaulicht werden. Problematisch ist dabei nur, dass sich als Lösungsmittel auf Wasser beschränkt wird und zum Beispiel Reaktionen in flüssigem Ammoniak oder Alkoholen nicht betrachtet wird.
Nach Brönsted
Die Definition von Brönsted ist deutlich umfassender, da sie Funktionen von Stoffen und keine einzelnen Stoffe beschreibt. Nach Brönsted sind Säuren solche Moleküle oder Ionen, die Protonen abgeben können (Protonendonatoren).
Säure-Base-Paare
Wenn Stoffe als Säuren (Protonenabgabe) wirken, dann können die verbleibenden Stoffe die Funktion einer Protonenaufnahme durchführen (als Base wirken). Diese, zu den Säuren zugeordnete, Basen nennt man dann konjugierte Basen.

Wichtige Säuren
Salzsäure (HCl)
Salzsäure ist eine starke, ätzende Säure. Sie reagiert zum Beispiel mit unedlen Metallen unter Wasserstoffentwicklung, mit Metalloxiden und Kalkstein. Der Bedarf an großen Mengen Salzsäure wird aus der Umsetzung von Steinsalz mit Schwefelsäure gedeckt.
Schwefelsäure (H2SO4)
Schwefelsäure ist eine sehr starke und ätzende Säure. Sie zerstört organische Stoffe und zählt zu den wichtigsten Grundstoffen der Chemischen Großindustrie. Dabei wird sie als Elektrolyt in Bleiakkumulatoren, für die Herstellung von Düngemittel, Explosivstoffen und Kunstoffen benötigt. In Mischung mit Salzsäure bildet Schwefelsäure „Königswasser“.
Kohlensäure (H2CO3)
Kohlensäure zählt zu den schwachen Säuren. Zur Herstellung wird Kohlendioxid in Wasser gelöst. Bedeutsam sind dabei vor allem die Salze der Kohlensäure (Carbonate).
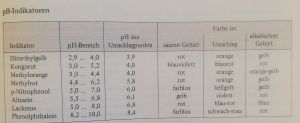
pH-Wert
Der pH-Wert beschreibt die Säuren- oder Basenwirkung von Flüssigkeiten. Dabei ist der pH-Wert der negative dekadische Logarithmus der Hydroniumionenkonzentration. Der pH-Wert 7 ist der neutrale Punkt. Für einen Wert größer als 7 gilt ein Stoff als basisch und für einen Wert kleiner als 7 ist der Stoff sauer. Je weiter dies vom neutralen Punkt entfernt ist, desto saurer/basischer ist der Stoff.[1]

Anwendung
https://learningapps.org/watch?v=pn2fqh8d222
Verweise
- ↑ vgl. Scheipers, P. (Hrsg.) & Biese, V. & Bleyer, U. & Bosse, M. (1993). Chemie- Grundlagen, Anwendungen, Versuche (3., verbesserte Auflage). Wiesbaden: Vieweg (S.152-170)