Basen: Unterschied zwischen den Versionen
DiMedS (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
DiMedS (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 7: | Zeile 7: | ||
==nach Brønsted== | ==nach Brønsted== | ||
Nach Brønsted besteht das Wesen einer [[Säure]]-Base-Reaktion, also einer Protolyse, im Übergang von Protonen von einer Säure zu einer Base. Basen spielen dabei die Rolle des Protonenakzeptors. | Nach Brønsted besteht das Wesen einer [[Säuren|Säure]]-Base-Reaktion, also einer Protolyse, im Übergang von Protonen von einer Säure zu einer Base. Basen spielen dabei die Rolle des Protonenakzeptors. | ||
=Säure-Base-Paare= | =Säure-Base-Paare= | ||
Version vom 8. Juli 2022, 11:02 Uhr
Unter Basen lassen sich alle Verbindungen, die in wässriger Lösung in der Lage sind, Hydroxidionen zu bilden auffassen. Dabei können die Hydroxidionen, die Protonen von einer Säure unter Bildung eines Wassermoleküls übernehmen und damit schlussfolgernd die Säure neutralisieren. Dadurch lassen sich Basen als Gegenstück von Säuren beschreiben.
Definition
nach Arrhenius
Basen sind Stoffe, die in wässriger Lösung zu frei beweglich elektrisch positiv geladenen Metallionen und frei beweglich elektrisch negativ geladenen Hydroxidionen dissoziieren.
nach Brønsted
Nach Brønsted besteht das Wesen einer Säure-Base-Reaktion, also einer Protolyse, im Übergang von Protonen von einer Säure zu einer Base. Basen spielen dabei die Rolle des Protonenakzeptors.
Säure-Base-Paare
Säuren und konjugierte Basen bilden zusammen ein Säure-Base-Paar. Säure ⇌ Base + Proton Die Abspaltung von Protonen kann jedoch nicht als isolierte Reaktion erfolgen, sondern muss mit einer zweiten Reaktion kombiniert werden, die die Protonen verbraucht. Ursache hierfür ist, das freie Protonen in gewöhnlicher Materie nicht existieren können. In wässrigen Lösungen lagern sich die Protonen an Wassermoleküle an, die als Base wirken. Durch die Aufnahme eines Protons entsteht dabei die Säure Hydroniumion. [1]
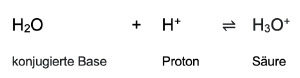
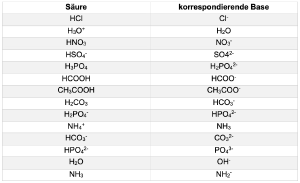
Hier finden sie eine Tabelle mit den Säure-Base-Paaren:
Anwendung
Verweise
- ↑ vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2007), Anorganische Chemie, 7. Auflage, Berlin, Seite 320