Benzol
Benzol (Synonym: Benzen; Summenformel: C6H6) auch als "Mutter der Aromaten" bezeichnet, stellt das Grundmolekül der Aromatenchemie dar. Kennzeichnend für die Chemie der Aromaten ist ihre Stabilität, welche auf den ersten Blick im Widerspruch zu ihrer Struktur zu sein scheint. Jedoch nur auf den ersten Blick, denn eben wegen ihrer besonderen Struktur und Stabilität sind die Reaktionen die solche Verbindungen eingehen keine klassischen Addition.
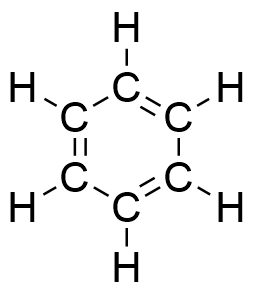
Geschichte des Benzols
Entdeckung
Das Mysterium um die Struktur des Moleküls
Struktur des Benzols genauer betrachtet
Besonderheiten
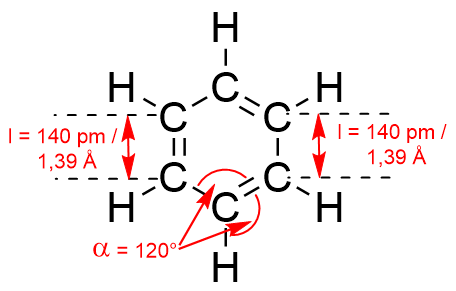
Wie oben bereits gezeigt sorgte die Struktur des Benzols bei vielen Chemikern der damaligen Zeit lange für Kopfzerbrechen. Grund dafür ist unter anderem das von der klassischen Bindungslehre abweichende Erscheinungsbild. Mittels instrumenteller Analytik können Bindungslängen und Bindungswinkel des Benzols ermittelt werden.
| C-C Einfachbindung | C=C Doppelbindung | Benzol |
|---|---|---|
| 154 pm | 134 pm | 140 pm |
Weshalb steht dies nun im Widerspruch?
Es scheint sich gleichzeitig um Doppelbindungen und gleichzeitig um Einfachbindungen zu handeln. Die normale C-C Einfachbindung beträgt l = 154 pm, die einer C=C Doppelbindung dagegen l = 134 pm. Somit ist die Bindungslänge im Benzol weder Einfach- noch Doppelbindung, sondern liegt dazwischen.
Da alle Bindungslängen gleichlang sind und die Bindungswinkel jeweils 120° betragen, ist das Molekül planar. Es befinden sich also alle an den Bindungen beteiligten Atome in einer Ebene.
Mesomerie und besondere Stabilität der Aromatizität
Erhöhtes Anforderungsniveau: Struktur des Benzols genauer betrachtet II
Orbitalmodell der Aromaten
HÜCKEL-Regel - Aromatizität und Antiaromatizität
Eigenschaften des Benzols
Physikalische Eigenschaften
Chemische Eigenschaften
Vielfalt der Aromaten
Erhöhtes Anforderungsniveau: Vielfalt der Aromaten II
Annellierte/Kondensierte Aromaten
Heteroatomaromaten
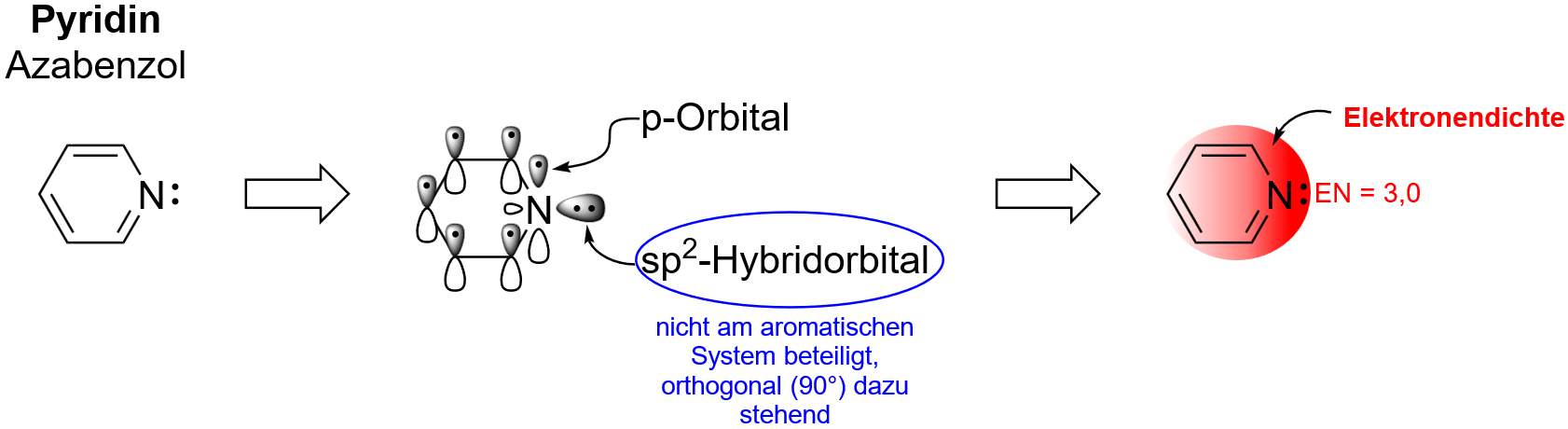
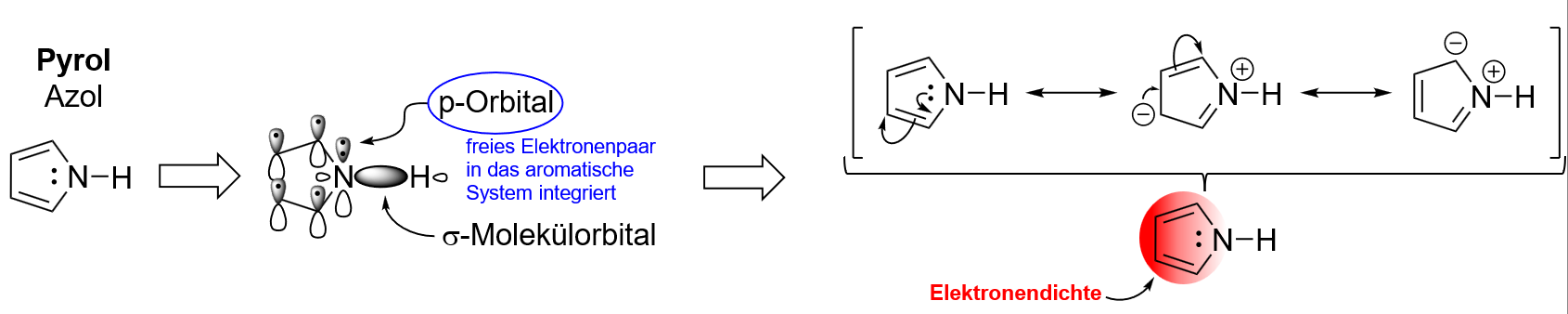
Heteroatomaromaten (Synonym: Heteroaromaten) enthalten neben Kohlenstoff auch Heteroatome wie Sauerstoff, Stickstoff, Schwefel oder Phosphor im Ringgerüst gebunden. Wie bereits erwähnt spielen Heteroaromaten eine wichtige Rolle in biologischen Systemen.
Wir betrachten hier nun mehr die Struktur und elektronischen Eigenschaften zweier wichtiger Gruppen der Heteroaromaten.
A - Elektronenmangel-Aromaten
B - Elektronenüberschuss-Aromaten
Übungsaufgaben
Grundlegendes Anforderungsniveau
AFB I/II:
Benzaldehyd kann bereits an Luft schnell zu Benzoesäure reagieren. Stellen Sie das Redox-System für die Reaktion von Benzaldehyd mit Eisen(III)-Ionen auf. Geben Sie in beiden Teilgleichungen für alle Atome die Oxidationszahlen an.
AFB III:
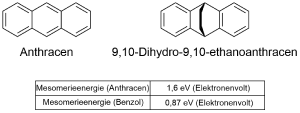
In der nebenstehenden Abbildung werden Ihnen zwei Moleküle gezeigt - Anthracen und 9,10-Dihydro-9,10-ethanoanthracen. Äußern Sie eine Vermutung zur thermodynamischen Stabilität beider Verbindungen unter Nutzung der in der Abbildung gegebenen Werte für die Mesomerieenergie, sowie ihrer Kenntnisse zur Mesomerie.
TIPP: Betrachten Sie sich die Anzahl der Elektronen jedes einzelnen Rings.
Erhöhtes Anforderungsniveau
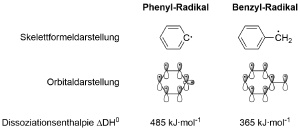
Äußern Sie sich zur Stabilität des Phenyl-Radikals im Vergleich zum Benzyl-Radikal. Nutzen Sie dazu die Informationen, die Ihnen die nebenstehende Abbildung gibt.