Basen
Unter Basen lassen sich alle Verbindungen, die in wässriger Lösung in der Lage sind Hydroxid-Ionen zu bilden, auffassen. Dabei können die Hydroxid-Ionen, die Protonen von einer Säure unter Bildung eines Wassermoleküls übernehmen und damit schlussfolgernd die Säure neutralisieren. Dadurch lassen sich Basen als Gegenstück von Säuren beschreiben.
Definition
nach Arrhenius
Basen sind Stoffe, die in wässriger Lösung zu frei beweglich elektrisch positiv geladenen Metallionen und frei beweglich elektrisch negativ geladenen Hydroxid-Ionen dissoziieren. [1]
nach Brønsted
Nach Brønsted besteht das Wesen einer Säure-Base-Reaktion, also einer Protolyse, im Übergang von Protonen von einer Säure zu einer Base. Basen spielen dabei die Rolle des Protonenakzeptors. [2]
Säure-Base-Paare
Säuren und konjugierte Basen bilden zusammen ein Säure-Base-Paar.
Säure ⇌ Base + Proton
Die Abspaltung von Protonen kann jedoch nicht als isolierte Reaktion erfolgen, sondern muss mit einer zweiten Reaktion kombiniert werden, die die Protonen verbraucht. Ursache hierfür ist, das freie Protonen in gewöhnlicher Materie nicht existieren können. In wässrigen Lösungen lagern sich die Protonen an Wassermoleküle an, die als Base wirken. Durch die Aufnahme eines Protons entsteht dabei die Säure Hydroniumion. [3]
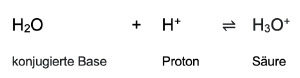
Hier finden sie eine Tabelle mit den Säure-Base-Paaren:
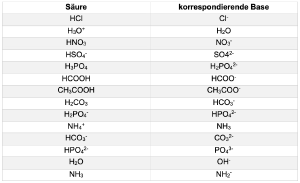
wichtige Basen
Natriumhydroxid NaOH
Natriumhydroxid ist eine weiße, kristalline Substanz, die auch als Natronlauge bekannt ist. Diese Verbindung wirkt ätzend auf Haut, Schleimhäute und Augen. Natriumhydroxid ist eine exotherme Verbindung, die in Wasser und Alkohol leicht löslich ist. Es ist eine hygroskopische Substanz.
Festes Natriumhydroxid reagiert auch mit Kohlenstoffdioxid in der Luft zu Natriumcarbonat, daher sollte es fest verschlossen gelagert werden. [4]
Ammoniak NH3
Ammoniak ist ein farbloses Gas und mit einem einem besonders stechendem Geruch und ist leicht wasserlöslich. Die wässrige Lösung reagiert basisch, da die Brønsted-Base Ammoniak dem Wasser ein Proton entzieht und damit Hydroxid-Ionen in der Lösung vorliegen:
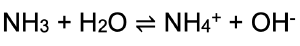
Ammoniak wird ausschließlich nach dem 1913 entwickelten Haber-Bosch-Verfahren gewonnen und wird bei der Herstellung von Düngemitteln, Kunststoffen und Pflanzenschutzmitteln verwendet.[5]
Anwendung
https://learningapps.org/display?v=pw7fqv35a22
Verweise
- ↑ vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2015), Anorganische Chemie, 9. Auflage, Berlin, Seite 343
- ↑ vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2015), Anorganische Chemie, 9. Auflage, Berlin, Seite 343
- ↑ vgl. de Gruyter GmbH & Co. KG (Hrsg.) & Riedel, E. & Janiak, C. (2015), Anorganische Chemie, 9. Auflage, Berlin, Seite 344
- ↑ vgl. https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/wichtige-anorganische-basen#
- ↑ vgl. https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/wichtige-anorganische-basen#